Suların klorlanmasının amacı sudan geçen hastalıkların yayılmasını önlemektir. Klor normal sıcaklık ve basınçta sarımsı yeşil renkli, havadan daha ağır bir gazdır. Yükseltgen özellik taşıyan aktif bir elementtir. Sulu ortamda bütün maddelerle etkileşir. Klor gazı suya ilave edildiğinde ard arda iki reaksiyon görülür; hidroliz ve iyonizasyon. Hidroliz reaksiyonunda HOCl, iyonizasyon reaksiyonunda ise OCl– oluşur. Bu iki reaksiyon aşağıdaki gibidir.
Cl2 + H2O⇔ HOCl + H+ + Cl– Hidroliz reaksiyonu
HOCl ⇔ H+ + OCl– İyonizasyon Reaksiyonu
HOCl (hipokloröz asidi) kuvvetli OCl– ise zayıf bir dezenfektandır. Bu nedenle birinci reaksiyonun sağa, ikinci reaksiyonun sola doğru olması istenir. Bu ise belli aralıkta pH değerlerinde mümkündür. Seyreltik çözeltilerde pH>4 ‘ de yukarıda verilen denge büyük ölçüde sağa doğru kayar, çözeltide çok az klor kalır. Serbest kalıntı klor, HOCl ve OCl– ‘nin toplamı olarak tanımlanır. Çoğunlukla klorlama verimliliğinin bir ölçüsü olarak kullanılır. Belirgin bir serbest kalıntı klor değeri 0,5-1,0 g/m3 elde etmek su temin sistemlerinde standart amaçtır. Denklemlerden de görüldüğü gibi uygulanan klor, ya suda çözünür, ya da HOCl veya OCl– formuna geçer. Böylece bu üçünün toplamı olarak tanımlanan serbest kalıntı klor, çözeltide kullanımdan arta kalan ve suyu daha sonraki bulaşmalardan koruyan yararlanılabilir klorun bir ölçüsüdür. Bu üç formun farklı dezenfektan gücü vardır. Bu nedenle yararlanılabilir klor içinde türlerin dağılımı çok önemlidir. Klor ihtiyacı; suya ilave edilen klor ile belli bir temas süresi sonunda kalan serbest klor ve yararlanılabilir klor arasındaki farktan bulunur. Hiç indirgen madde içermeyen sularda eklenen klor dozuna karşı kalıntı klor beklentisi 45° bir eğri çizer. İndirgen maddeler ve amonyak içeren bir suya klor ilave edildiğinde dalgalı bir eğri elde edilir. Uygulanan klor dozunun doğal veya atık sularda oluşturduğu kalıntı klor derişimini izleyerek, suların klor ihtiyacını belirlemek bu eğri yardımıyla mümkün olur. TSE’ ye göre sudaki serbest klor miktarı su sınıflarına göre aşağıda verilmiştir.
| Su Serbest Klor değeri | I (Su Kalite Sınıfı) | II (Su Kalite Sınıfı) | III (Su Kalite Sınıfı) | IV (Su Kalite Sınıfı) |
| Sıcaklık (oC) | 25 | 25 | 30 | 30 |
| Klor (g/L) | 10 | 10 | 50 | 50 |
EPA’ ya göre ikinci sınıf su için standartlar aşağıdaki tabloda verilmektedir. Klorid miktarı 250 mg/lt olarak verilmiştir.
| Contaminant | Secondary MCL | Noticeable Effects above the Secondary MCL |
| Aluminum | 0.05 to 0.2 mg/L* | colored water |
| Chloride | 250 mg/L | salty taste |
| Color | 15 color units | visible tint |
| Copper | 1.0 mg/L | metallic taste; blue-green staining |
| Corrosivity | Non-corrosive | metallic taste; corroded pipes/ fixtures staining |
| Fluoride | 2.0 mg/L | tooth discoloration |
| pH | 6.5 – 8.5 | low pH: bitter metallic taste; corrosion high pH: slippery feel; soda taste; deposits |
| Silver | 0.1 mg/L | skin discoloration; graying of the white part of the eye |
| Sulfate | 250 mg/L | salty taste |
| Total Dissolved Solids (TDS) | 500 mg/L | hardness; deposits; colored water; staining; salty taste |
| Zinc | 5 mg/L | metallic taste |
İyodometrik metodla klor tayininde serbest ve birleşik klor kalıntılarının iyodürü iyoda dönüştürmesine dayanır. Oluşan iyot nişasta ile mavi renk verir. Bu test kalıntı klorun varlığına işarettir fakat mevcut kalıntı klor miktarını göstermez. Titrasyonda reaktif olarak sodyum tiyosülfat kullanılır. Dönüm noktası mavi rengin kaybolması ile saptanır.
Dezenfeksiyon işlemi çeşitli yöntemlerle örneğin kimyasal dezenfektanlarla, klorla, UV veya ozonla yapılmaktadır. En çok tercih edilen klorla dezenfeksiyon yöntemidir. Klorla dezenfeksiyonun tercih edilme nedenleri şöyledir;
- Sonuçların kontrol edilebilmesi
- Etkinliğinin başka bir deyişle yükseltgenme özelliğinin yüksek olması
- Kimyaca saf olması
- Uygulama kolaylığı
- Dezenfeksiyon işlemi için gerekli tesisin basit oluşu
- Depolama ve nakliyesinin kolaylığı
- Ekonomik oluşudur.
Atıksuların klorlanmasında en önemli etken klor ihtiyacının belirlenmesidir. Buda kırılma noktası klorlaması şeklinde gerçekleşir.
KIRILMA NOKTASI KLORLAMASI
Yaygın olarak uygulanan klorla dezenfeksiyon yönteminde atıksuya eklenen klor ile ölçülen serbest klor değerleri farklılıklar gösterecektir. Bunun temel nedeni eklenen klorun atıksuda çeşitli reaksiyonlara girmesidir. Dolayısıyla eklenen klorun bir kısmı kullanılacaktır. Tüm bu reaksiyonların gerçekleşmesinden sonra atıksuya eklenecek olan klor ile serbest klor doğrusal olarak artış gösterecektir. Eklenen klora karşılık atıksu içerisindeki serbest klor ölçüldüğünde bir kırılma noktası oluştuğu gözlenir. Buna kırılma noktası klorlaması adı verilir. Şekil 1’de kırılma noktası klorlaması gösterilmektedir.
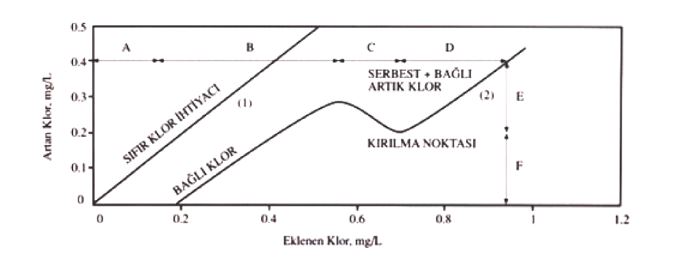
Şekil 1. Kırılma noktası klorlamasının şematik gösterimi
Klor dozlanmaya başladığında önce suda bulunan organik maddeler klorla reaksiyon vererek yükseltgenir ve kloru klorür iyonuna indirgerler. A bölgesinin sonundan itibaren suda sadece amonyak kalmıştır. Bu noktadan itibaren klor dozlaması devam ettirildiğinde kloraminlerin oluşumu başlar ve bu oluşum klor / amonyak mol oranının 1 olduğu B bölgesi sonuna kadar devam eder. Bu noktaya kadar oluşan kloraminler monokloramin ve dikloramindir. Bunların oranı pH ve sıcaklığa bağlı olmakla birlikte hâkim olan bileşik monokloramindir.
C Bölgesi süresince klor dozlanmaya devam edildiği takdirde ortamdaki artık klor (serbest hazır klor ve bağlı hazır klor toplamı ) azalmaya başlar. Bu azalmanın nedeni kloraminlerin klor ile ve kendi aralarında verdikleri reaksiyonlardır.
Kırılma noktasında (C noktası bitişi), ortamdaki mono ve dikloramin pratik olarak tamamen uzaklaştırılmıştır. Kırılma noktasının ötesinde klor dozlanmaya devam edildiğinde klor, ortamda ancak eser miktarda kalan dikloramin ile trikloramin dışında serbest klor halinde ilave edildiği miktarda artar. D noktasında ise kullanılacak tüm klor kullanılmış olup, eklenen klor miktarı kadar bir artış gözlemlenecektir. Yani klor artışı artık eklenen klor artışına paralel olarak aynı oranda artacaktır. E kısmı ise, suda serbest halde bulunana klor miktarını göstermektedir.
Kırılma noktası klorlamasında suda, yukarıda belirtilen kolayca oksitlenen inorganik ve organik maddeler, örneğin azot içeren organik maddeler hemen oksitlenmez ve kırılma noktası eğrisinin şeklini etkiler. Bazı azot içeren organik maddeler, örneğin amino asitler klorla tamamen parçalanmaz. Kırılma noktası klorlaması içme suyu arıtımında ve atık su arıtımında uygulanabilmektedir. Kırılma noktası klorlaması ayrıca bir azot giderme yöntemi olarak ta kullanılmaktadır.
Kısaca bu olayın açıklanması gerekirse yeterli miktarda klor, inorganik bileşikler ve azotlu bileşikler ile reaksiyona girmesi için ilave edilirse, ilave klor, en yüksek dezenfeksiyon gücüne sahip olan ‘Serbest Bakiye Klor’ şeklinde bulunacaktır. Bu durum, azotlu bileşikler içeren atık sularda nadiren meydana gelir. Bu nedenle kırılma noktası klorlaması atıksudaki klor ihtiyacını belirlememize yardımcı olur.
Evsel atık su veya endüstriyel atık sularda klor ihtiyacının tayini, projelendirmede önemli bir faktördür. Gerekli klorinatörlerin sayısı ile kullanımı için gerekli klor miktarını, tahliye kayıplarının tipini, klorun elde etme ve depolama için gerekli tüm aksamın belirlenmesinde yararlıdır.
Klor dozu = Klor ihtiyacı + Klor bakiyesi
Klor bakiyesi = Bağlı klor formları + Serbest klor formları
ANALİZ YÖNTEMİ
KULLANILAN MALZEMELER
- Petri kabı
- Ekiviyon çubuğu
- Bek alevi
- Pipet
REAKTİFLER
- Asetik asit
- Potasyum iyodür, KI, kristal formda
- Standart Sodyum Tiyosülfat, 0,1 N: 25 g Na2S2O3.5H2O 1 L saf suda çözülür
- Standart Sodyum Tiyosülfat, 0.01 N veya 0.025 N: Daha önce hazırlanmış olan 0,1 N Na2S2O3 çözeltisinden seyreltmeler yapılarak 0.01 ve 0.025 N Na2S2O3 çözeltileri hazırlanır ve yukarıdaki şekilde standardize edilir. 0.01 ve 0.025 N çözeltileri Cl2/l mL cinsinden sırasıyla 354.5 ve 886.3 μg Cl’a eşdeğerdir.
DENEYİN YAPILIŞI
- Numune hacmi: 0,01 N Na2S2O3’den 20 mL den daha az sarf edecek şekilde numune alınır. 1-10 mg/L klor ihtiva eden numuneler için 500 mL numune kullanılabilir.
- Numunenin hazırlanması: 5 mL asetik asit veya pH’ı 3–4 civarında düşürmeye yetecek miktarda asetik asit, bir erlene yerleştirilir ve yaklaşık 1 g KI ilave edildikten sonra numune bu kaba boşaltılarak karıştırılır.
- Titrasyon: Güneş ışığından uzakta titrasyon yapılır. 0,025 N veya 0,01 N Na2S2O3, iyodürden kaynaklanan sarı renk azalana kadar numuneye ilave edilir. Daha sonra 1 mL nişasta ilave edilir ve mavi renk kaybolana kadar titrasyona devam edilir.
- Şahit titrasyonu: Deneyde kullanılan numune kadar saf su numunesi ile yukarıdaki işlemler uygulanır. Şahit titrasyonu aşağıdaki iki şekilde gerçekleşebilir. Klor konsantrasyonu hesaplanmadan önce şahit titrasyonundan kaynaklanan sarfiyat numunenin sarfiyatından çıkarılmalıdır.
HESAPLAMA
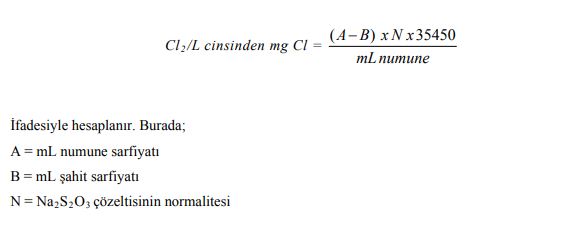
İfadesiyle hesaplanır. Burada;
- = mL numune sarfiyatı
- = mL şahit sarfiyatı
N = Na2S2O3 çözeltisinin normalitesi



Yorum yap