a) Fiziksel Özellikleri:
1. Sıcaklık
2. Renk
3. Viskozite (Akmazlık)
4. Koku ve Tat
5. Berraklık ve Bulanıklık
b) Kimyasal Özellikleri:
1. pH
2. Çözünmüs Gazlar,
3. Salinite (Tuzluluk),
4. Kondüktivite (İletkenlik),
5. Biyolojik Oksijen İhtiyacı (BOİ, BOD)
6. Sertlik
A) Fiziksel Özellikleri:
1. Sıcaklık
Denizlerin sıcaklığı bir yandan suların soğumasına, diğer yandan ısınmasına tesir eden faktörlerin etkisi altındadır. Sıcaklık gölün yüzeyinde derinliklere doğru derece derece azalır. Bu azalma 40C’ye kadar iner. Bu sıcaklık tabakalaşması sonucu en üstte ılımlı bir kat (epilimnion), onun altında dar bir geçit katı (metalimnion, termoklin) ve daha altta dip kat, soguk kat (hipolimnion) olusur.
2. Renk
Suyun rengi denilince suyun içindeki koloidal maddelerin sonucu olusan renk anlasılır. Suyun içinde süspansiyon halinde bulunan canlı ve cansız maddeler ile gökyüzü veya suyun tabanından dolayı olusan renk görüntüleri buna dâhil degildir. Gökyüzünün açık oldugu zamanlarda kumlu kıyıların sarı, yosunlu yerlerin parlak yesil, fazla miktarda fitoplankton kapsayan suların yesil, yaz günlerinde gökyüzünden dolayı mavi renk sularda görülen renkler olup, suyun gerçek rengi degildirler.
3. Viskozite (Akmazlık)
Bir sıvı içindeki moleküllerin çekim ve sürtünme kuvvetleri nedeniyle akma egilimine karsı gösterdiği iç dirence “viskozite” denir. Akmazlıgın meydana gelebilmesi için bir kafes düzeninde olansıvı moleküllerini bağlayan bağlama kuvvetinin yok edilmesi gerekir. Böylece gevseyen moleküller hareket edebilirler. Su diğer sıvılarla karsılaştırıldığında, örneğin benzin, akıcılığa son derece dirençlidir. Bunun nedeni su moleküllerini bağlayan hidrojen bağlarının çok miktarda enerji kapsamasıdır. Suyun viskozitesinin yüksek olması akmayı sınırlar. Viskozite suyun sıcaklıgı ile ters bir ilişkiye sahiptir. Sıcaklık arttıkça viskozite azalır. Deniz suyunun viskozitesi, tatlı suyunkinden biraz daha fazladır.
4. Koku Ve Tat
Özellikle organik maddelerin varlıgı yüzünden ortaya çıkan ve kullanıcılar tarafından hissedilen bir parametredir. Koku ve tat olarak sularda genellikle beraberce bulunur. Tat ve koku giderilirken koku ölçümü olan Threshold koku seviyesi esas alınır. Koku ve tadın sebepleri: evsel atıksuların su kaynağına karışması, su kaynagındaki canlı organizmaların ölümü sonrası olusan organik maddelerin çürümesi, klor ve fenollü klor bilesikleri, hidrojen sülfür ve metan gibi çözünmüs gazlar, tarım ilaçlarının su kaynagına karısmasıdır.
Genellikle su kaynaklarında koku ve tat, alglerden, ikinci olarak da bitkilerin çürüyüp ayrısmasından kaynaklanır. Anaerobik ayrısma neticesinde oluşan H2S ve CH4’e çözünmüs oksijenin mevcut oldugu nehir sularında rastlanmaz. Bu gazlar genellikle göl ve hazne dibinde olusan anaerobik ortamda bitkilerin ayrısması ile olusur. Koku ve tat kontrolü ikiye ayrılabilir: Su kaynaklarının korunması, Arıtma tesisinde koku ve tat giderilmesi. Arıtma tesisinde koku ve tat giderilmesi için uygulanılan yöntemler: Havalandırma, Kimyasal Oksidasyon, Dezenfeksiyon, Adsorbsiyon.
5. Berraklık (Transparansi) Ve Bulanıklık (Turbidite)
Saf su oldukça berraktır. Berrak suda ısık çok az bir kayıpla su altında oldukça derinlere inebilir.
Dogal su hiçbir zaman saf su kadar berrak değildir; çünkü içinde çözünmüs maddeler, mikroskobik canlılar, askıntı maddeler vb. birçok parçacık bulunur. Berraklıgı çesitli nedenlerle azalan sulara bulanık su adı verilir. Az bulanık sular canlılar için gerekli maddeleri daha fazla talıdıgından, yasama ortamı olarak daha elverişlidir. Akarsuların asagı havzalarında (ilkbaharda üst havzada) bulanıklık en yüksek düzeydedir. Turbiditenin yoğun olmadığı akarsularda plankton gelişerek suyun yesil görünmesine neden olabilir. Akarsuların çoğu akış sırasında oldukça fazla alüvyon ve diger ince parçacıkları taşıdığından bulanık örülür. Bulanık suda ışık çok çabuk soğurulduğundan fitoplankton azalır.
b) KİMYASAL ÖZELLİKLER:
1. pH
pH, bir çözeltideki H+ iyonu konsantrasyonunun (–) logaritmasıdır. pH = – log [H+], pH=7 ise nötr, pH < 7 ise asidik, pH > 7 ise bazik sulardır. Sularda pH tayini örnek alınır alınmaz derhal ve eger mümkün ise, örneğin alındığı yerde yapılmalıdır. Eger su örnegi laboratuvara bir sise içerisinde getirilmis ise, sise açılır açılmaz ilk yapılacak tayin pH olmalıdır. Aksi halde örnek laboratuvar havasından etkilenecek ve gerçek pH degeri degisebilecektir.
1.1. Deneyin Adı: Suda Alkalinite Tayini
GENEL BİLGİ: Alkalinite, suların asit baglama gücü; nötralizasyon kapasitesinin ölçüsüdür. Yüzeysularının alkalinitesi baslıca karbonat, bikarbonat ve hidroksit muhtevasından dolayıdır, bunların konsantrasyonlarına bakılarak yorumlanır. Alkaliniteye aynı zamanda boratlar, fosfatlar, silikatlar ve var ise diger bazlar katkıda bulunabilir. Fenolfitaleyn ve total alkalinite olmak üzere ölçüm yapılır. Fenolfitaleyn alkalinitesi: Sadece serbest karbon dioksit yoksa ölçülür, yani pH’ın 8.3’ü geçtigi durumlarda vardır. Bu alkalinite toplam alkalinitenin hiçbir zaman yarıdan fazlasını geçmemelidir, yoksakostik özelligi olan alkalinite olusur. İçme suyunun pH’ının > 10.6, 250C, olmaması tavsiye edilir, karbonat alkalinitesi ise > 120 ppm olmamalıdır.
DİKKAT: KLORUN VARLIGI SONUÇLARI DEGİSTİRİR.
Kullanılan indikatör çözeltilerin renk degisimleri: Metiloranj pH > 4.4 olan bir çözeltide sarı olacaktır; pH 5 olan zayıf asiti ve pH 14 olan kuvvetli bazı ayırt edemeyecektir. Fenolfitaleyn alkalinitesi ölçülürken numune, dilüe sülfürik asit ve fenolfitaleyn indikatörü kullanılarak pH 8.3’e nötralize edilir. Bu islem hidroksit iyonlarını suya; karbonat iyonlarını da bikarbonat iyonlarına çevirir: Total alkalinite: Bikarboant iyonları ilave sülfürik asit eklenmesiyle karbonik asite dönüseceginden, fenolfitaleyn alkalinitesi toplam hidroksit iyonlarını ölçer, ancak karbonatın katkısının sadece yarısını tayin edebilir.
Bütün karbonat iyonlarını dönüstürebilmek için numunenin pH’ı 4.5 olana kadar sülfürik asit eklenir. Buna da total alkalinite denir. OH-, CO32- ve HCO3- nin hepsini nötralize etmek ve pH’ı 4.5 yapmak için gerekli toplam asit miktarına (mol) total alkalinite denir. 200C’deki 1 L deniz suyunu nötralize edebilen H+ iyonunun mili esdeger (milliekivalen) sayısına o suyun alkalinitesi denir. Alkalinite su kaynagının sulama ve endüstriyel kullanıma uygunlugunu beliremede, suyun ham halinin özelliklerini tanımlamada ve atıksu izlemede kullanılır. Su kaynagında asit çökelmesi veya kaza ile suya asit ilavesi ile olusabilecek pH degisikliklerinin indikatörü olarak da önemlidir.
MATERYAL: HCl ve H2SO4, 0.1 N (N/10) veya 0.02 N veya N/50
Fenolfitaleyn indikatörü çözeltisi (0.05 g tartılıp, %50 etanolde çözülür veya %1 w/v
olacak sekilde 1 g indikatör 70 ml etanolde çözülüp, distile su ile 100 ml’ye tamamlanır)
Metiloranj indikatörü çözeltisi (karanlık sisede saklanmalıdır), %0.01’lik distile suda
Bromkresol yesili indikatörü çözeltisi
Beher, 150 ml
Büret, 25 veya 50 ml
Mezür, 100 ml
pH metre
DENEYİN YAPILISI-A:
• 25 veya 50 ml ml su örnegi su alınır, behere konarak pH’ı ölçülür.
• 2-3 damla (genellikle 100 ml için 5 damla) fenolfitaleyn indikatörü damlatılır. Pembe renk olusursa fenolfitaleyn alkalinitesi mevcuttur. • Renk olusmaz ise fenolfitaleyn alkalinitesi sıfırdır. Test tamamlanmıstır. Serbest CO2 olabilecegini de gösterir. • Eger indikatör eklendikten sonra pembe renk olusursa, N/50 sülfürik asiti çok yavas ve dikkatlice büretten örnegin üzerine damlatın, bu islemi renk yok olana kadar yapın. Asiti eklerken, kabınızı cam baget ile nazikçe karıstırın. Bu dönüm noktasını takip etmenin en garantili yolu pH metre kullanmaktır çünkü renk 8.3’de kaybolur.
Fenolfitaleyn Alkalinitesinin Hesaplanması:
Pembe rengin uzaklasmasını saglayan asitim mililitresi 10 ile çarpılarak fenolfitaleyn alkalinitesi ppm (milyonda kısım) cinsinden bulunur. Kullanılan asitin her 0.1 ml’si 1 ppm fenolfitaleyn alkalinitesine esittir.
Örnek: eger 2.4 ml asit kullanıldıysa, fenolfitaleyn alkalinitesi 2.4 × 10 = 24 ppm olur.
• Eger pH > 8.3 ise (muhtemelen sizin numunenizde böyle olmayacaktır…) birkaç damla
fenolfitaleyn indikatörü damlatın.
• Numunenizi 0.02 N H2SO4 veya HCl ile pH dönüm noktasına kadar (renk degisimi) titre edin. Bu fenolfitaleyn alkalinitesidir.
• Bu dönüm noktasına ulasmak için gerekli toplam asit hacmini kaydedin.
• Eger pH < 8.3 ise, birkaç damla bromkresol yesili indikatörü damlatın. Numunenizi 0.02 N H2SO4 veya HCl ile pH dönüm noktasına kadar (rengin maviden sarıya degismesi) titre edin. • Bu dönüm noktasına ulasmak için gerekli toplam asit hacmini kaydedin.
Deney_N Yapılısı-B:
• 25 ml su örnegine 2-3 damla metiloranj indikatörü damlatılır. Alkalinite var ise örnegin rengi sarı
olur.
• N/10 HCl ile sarı renk hafif pembemsi oluncaya kadar titrasyon yapılır. Alternatif olarak N/50
sülfürik asit ile büret yardımıyla titrasyon yapılır. Numunenin rengi artık sarı kalmayana kadar
titre edilir.
• Renk pembeye döndügü anda büretten harcanan miktar tespit edilir (C ml).
• pH metre ile titrasyon takip ediliyorsa pH 4.5 olana kadar titrasyon yapılır.
Degisik pH aralıkları için alkalinite sınırları pH Aralıgı Total Alkalinitenin Sınırları
(CaCO3 cinsinden ppm )
| 8.0 ila 9.6 | 400 |
| 9.7 | 340 |
| 9.8 | 300 |
| 9.9 | 260 |
| 10.0 | 230 |
| 10.1 | 210 |
| 10.2 | 160 |
| 10.3 | 180 |
| 10.4 | 170 |
| 10.5 ila 10.6 | 160 |
Total Alkalinitenin Hesaplanması:
m muneAxNxL
mgCaCO
Alkalinite ln50000( 3 )=
A: kullanılan asitin ml’si
N: kullanılan asitin normalitesi
Bikarbonat alkalinitesi (TOTAL) = 4 x C meq/l (CaCO3); 1 meq/l CaCO3 = 50 mg/l CaCO3
2. Çözünmüs Gazlar
Deniz suyu içerisinde çözünmüs oksijen miktarı litre basına 0-10 ml arasında degisir. Sıfır degeri tamamen kirlenmis sularda digeri ise asırı doygunluga ulasmıs bölgelerde, örneginyüzeyde ve büyük fotosentez aktivitesinin olustugu yerlerde söz konusudur. Atmosferdeki bütün gazlar, sularda çözünmüs halde bulunur. Düsük oranlarda amonyak, argon, helyum, neon ve hidrojen gazları bulunurken; büyük miktarda azot, oksijen ve karbondioksit bulunur. Karbondioksit ise çözünürlügü çok olup karbonat ve bikarbonat halinde bulunur.
Azotun islevi (serbest haldeki sekli) biyolojik olaylarda pek önemi yoktur. Ancak bakteriler gibi mikroorganizmalar veya fitoplanktonlar için önemlidir. Reaksiyona girmeyen gazdır (inert gaz). Sulardaki çözünürlügü atmosfer basınca ile artarken düsün sıcaklık vetuzlulukta yine artmaktadır. Bütün canlılar yasamları için oksijene ihtiyaçları vardır. Sedimentte bulunan organik maddelerin, ölmüs bitki ve hayvanların parçalanması ve ayrısmasında bakterilerin etkisi önemlidir. Bakterilerde önemli miktarda oksijen tüketirler. Sularda yasayan bitkiler ve hayvanlarda önemli miktarda oksijen tüketimine neden olurlar. Çözünmüs oksijen miktarı basınç ile artar, sıcaklık ile azalır.
3. Salinite (Tuzluluk)
1 kg deniz suyunda tüm karbonatlar okside, bromür ve iyodür klorüre dönüstükten, organik maddeler yükseltgendikten sonra ve kalan 4800C’de sabit tartıma getirildikten sonra elde edilen kütlenin gram olarak agırlıgına tuzluluk denir. _ç sularda tuzluluk dört katyon grubu (Ca++, Mg++, Na+, K+) ve dört anyon grubu (HCO3 -, CO3 =, SO4 =, Cl-)’den olusur. İç sulardaki düsük tuzluluk derecesi canlıların dagılımını etkiler. Bazı bakteri ve algler homiosmotik (ancak hafif tuzluluk farklarına dayanabilir) ise ilkel bitki ve hayvanların birçogu euryhaline (büyük tuzluluk farklarına dayanabilir) özellikteki canlılardır.
4. Konduktivite (İletkenlik)
Suda çözünen tuzlarının toplam konsantrasyonunun ölçüsüdür. Tuzlar suda çözündügünde elektrigi ileten yüklü iyonlar verir. Sudaki iyon sayısı ne kadar fazlaysa, elektriksel kondüktivitesi o kadar yüksektir, örnek kirli sular. Elektrikî konduktivite (iletkenlik) denen bu parametre, çözeltideki atık madde miktarını ve tuzlulukla iliskisini yaklasık olarak gösterir. _letkenlik 1 cm2’lik alanda 1 cm aralıkla duran iki platin elektrod arasındaki direncin ölçümü olarak ifade edilir ve 250C’da her cm için mikroohms veya megaohms olarak belirtilir. Son yıllarda kondüktivite birimi olarak μS/cm kabul edilmistir. Genellikle dogal sularda iletkenlik yaklasık olarak çözünmüs katı maddelerin toplamıdır.
Dısarıya akıntısı olan göllerde total çözünmüs madde miktarı 100-200 ppm arasındadır. Akıntısı olmayan kapalı göllerde buharlaşma çözünmüş katı madde miktarını artırır, bazı hallerde 100.000 ppm’e kadar çıkabilir. Böyle, oldukça yüksek yogunluktaki göller ortalama 35.000 ppm yogunluga sahip olan denizlerden daha tuzludur. Dogal sular organik fosfor ve azot bileşikleri yanında sekerler, asitler ve vitamin gibi organik bilesikleri de kapsar. Ancak organik maddelerin çogunun olusumu ve rolü hakkında bilgiler henüz yeterli değildir.
5. Biyolojik Oksijen İhtiyacı (Bod, Boı)
Aerobik şartlar altında bakteriler tarafından organik maddelerin parçalanmasında
kullanılmak üzere gerekli olan oksijen miktarı BOD (BOI) olarak tanımlanır, mg/l olarak ifade
edilir. BOD ölçümü genellikle kanalizasyon veya endüstri atıklarının sudaki kirlenme derecesini oksijen miktarı cinsinden ifade etmek amacıyla kullanılmaktadır. Su kalitesi açısından BOD ölçümü çözünmüş oksijen (DO) degerinin degismesinin etkilenip etkilenmedigi açısından önemlidir. Diger bir ifade ile, suyun kimyasal ekolojisinde organik kirlenmenin bir ölçüsü olarak bilgi verir.
BOD deneyinde oluşan reaksiyonlar biyolojik olayların bir sonucudur. Reaksiyonların hızı su örneklerinde çözünmüs olan organik madde miktarına ve sıcaklıga baglıdır. Bu nedenle deneyin sabit sıcaklıkta (200C) yapılması gerekir. Teorik olarak organik maddelerin tam biyolojik oksidasyonu (yükseltgenmeleri) için sonsuz sürede bir zamana ihtiyaç vardır. Fakat uygulamada reaksiyonun 20 günde tamamlandıgı kabul edilmektedir. Bununla birlikte 20 günlük bir zaman aralıgı sonuç alma açısından oldukça uzundur. Bu nedenle 5 günlük bir bekleme süresi kabul edilmistir. BOD tayininde kullanılacak yöntemler kirliligin derecesine ve suyun yapısına göre değişir.
Tablo 1. Biyolojik Oksijen _htiyacı Degerlerine Göre Suların Sınıflandırılması
BOD (mg/l) Su Kalitesi
| 0-15 Temiz |
| 15-30 Orta |
| >30 Kirli Bu deger içme sularında 1.5’i geçmemelidir. |
6. Suların Sertligi
Genel olarak, herhangi bir suyun sertligi denildiginde o suyun sabunu çöktürme özelligi anlasılır. Sabun baslıca Ca++ ve Mg++ iyonları tarafından çökeltilir. Ancak iyonlara oranlara su kaynakları içerisinde daha az miktarda bulunan diğer metal iyonları da sabunun çöktürülmesinde etkilidirler. Fakat bu iyonlara oranla Ca++ ve Mg++ iyonları sularda daha fazla bulunduklarından, suların sertligi, su içerisinde çözünmüs olarak bulunan toplam Ca++ ve Mg++ miktarının CaCO3 esdegeri olarak tanımlanır. Sularda sertlige yol açan iyonların genellikle mg/l olarak CaCO3 esdegeri olarak gösterilmesinin nedeni, CaCO3’ın standard olarak kolaylıkla bulunabilmesi ve hesaplamalardaki kolaylık yönünden mol agırlıgının 100 olmasıdır.
Suyun sertligi içerisinde çözünmüs Ca++ ve Mg++ nadiren Sr++ ve Ba++’un bikarbonatları geçici sertlik veya karbonat sertligini, yine bu elementlerin karbonattan ayrı tuzları kalıcı sertligi verir. Geçici sertlik denilmesinin nedeni, belirli sartlarda her iki anyonun da serbest CO2 gazı açıga çıkarabilmesidir. Bir suyun sertligi, o suyun temas etmis oldugu topraklardaki minerallerin suda çözünmesiyle yakından ilgilidir. Yer altı suları daha fazla oranda mineral madde ile temas ettiklerinden yüzey sularından daha serttir. Ölçme kullanma sularının sertliklerine göre sınıflandırılması birçok ülkede ayrı ayrı kabuledilen temel esaslara göre yapılmaktadır.
Tablo 2. Ülkelere Göre Su Sertliğinin Sınıflandırılması
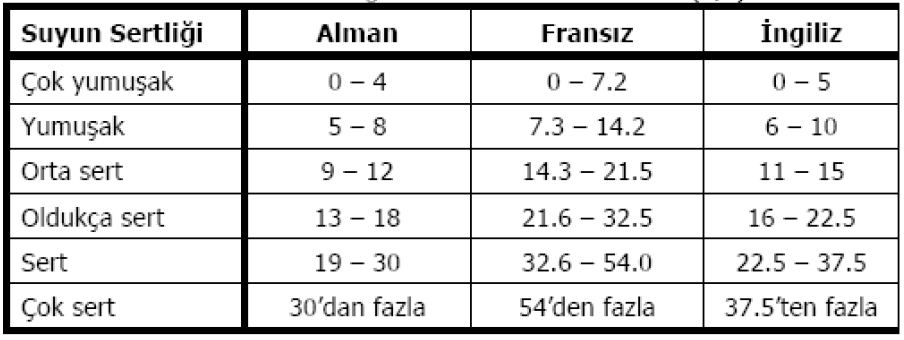
Bunlardan en çok kullanılan, Ülkemizde de, Fransız sertlik derecesidir.
6.1. Kalsiyum
Deniz sularında kalsiyum varlıgı, birçok deniz organizmalarının iskeletlerinin temelini olusturdugundan, biyolojik açıdan önemlidir. Kalsiyum deniz sularının üst tabakalarında ve kısmen de sediment içerisinde bulunur. Tatlı sularda kalsiyum ile metabolik iliskisi olmayan hiçbir canlı yok gibidir. Kalsiyum alglerin normal metabolizmasında büyümelerini saglayan önemli bir elementtir.
6.2. Magnezyum
Magnezyum sularda klorofilli bitkiler için hayatî önem tasır. Magnezyum porfirinin yapısına girdiginden, klorofilin bilesiminde bulunur. Enzim aktivitesinde kofaktör olarak da çok önemlidir. Alglerde, mantarlarda ve bakterilerde fosfor metabolizmasını düzenler. Tatlı sularda genellikle bu amaçların saglanmasına yetecek kadar magnezyum bulunur. Göllerde magnezyum seviyesinin düsük olması gölün fitoplankton bakımından verimliligini önemli ölçüde düsürür. 6.3. Deneyin Adı: Suyun Sertliginin Tespiti – Toplam Sertlik
Genel Bilgi: Suyun sertligi bilhassa Ca2+ ve Mg2+ katyonlarının suda çözünmesinden dolayıdır. Çoğu su analizleri bütün katyonların kalsiyum olduğu varsayılarak yapılır. Bazı musluk suları oldukça saf olup yumuşak su olarak bilinir. Deniz suyu söz konusu oldugunda aslında sertliğin çogu magnezyum iyonlarından gelmektedir. Yumuşak sular sabun ile kolaylıkla köpürür. Diğer sular ise çesitli çözünmüş safsızlıklar içerir ve sert su seklinde tanımlanır.
Geçici sertlik kaynatma ile giderilebilir, fakat kalıcı sertlik bu yolla giderilemez. Bu deneyde suyun sertligi; belirli hacimdeki su ile kalıcı bir köpük oluşturmak için harcanan sabun çözeltisinin hacmi bulunarak ölçülür (titrasyon). Titrasyonda Mg2+ ve Ca2+ ile selat yapan EDTA (etilendiamintetraasetik asit) kullanılmaktadır. Titrasyonda çözelti, magnezyum ve kalsiyum iyonlarının çözeltide kalmasını sağlamak için tamponlanır. Böylece toplam sertlik (Ca ve Mg) elde edilir.
Materyal: Her grup için;
- Erlen, 250 ml
- Erlenmeyer tıpası
- Büret ve büret tutucusu (Büretler hassas ve pahalı cam malzemelerdir. Çok dikkatli kullanınız.)
- Mezür, 50 ml
- Distile su (kaynatılmıs sogutulmus geçici sert su olarak etiketlenir)
- Degisik kaynaklardan su örnekleri (çesme suyu örnegi bir gece önce alınmalı kloru uçurulmalıdır)
- EDTA çözeltisi, 0.0100 M (disodyum EDTA, titriplex, MW= 372.24)
- Amonyaklı tampon (NH4Cl ve NH4OH kullanılarak hazırlanır)
- NaOH, 2 M
- Eriochrome Black T indikatörü, %0.1’lik
Meq = (N) (ml)
1 M HCl = 1 N HCl
1 M H2(SO4) = 2 N H2(SO4)
0.1 Normal (N/10)
1 M H3(PO4) = 3 N H3(PO4)
0.0100 (veya N/100) EDTA çözeltisi: 250 ml’lik bir balon jojeye 0.931 g EDTA koyunuz. Yaklasık 200 ml Milli-Q su ve 2-3 ml 6 M NaOH ekleyiniz. Bütün katı madde çözünene kadar çalkalayınız. Sonra 250.00 ml çizgisine kadar Milli-Q su ile hacim tamamlayınız. PET şişelerde yaklasık bir ay saklanabilir. 1 ml = 400.8 μg Ca.
Amonyaklı tampon: Çekerocak içinde çalısınız. 1.69 g NH4Cl’u 14.3 ml konsantre NH4OH içinde çözünüz. 25.0 ml’ye Milli-Q su ile hacim tamamlayınız. Agzı sıkıca kapanan şişede saklayınız.
%0.1’lik Eriochrome Black T indikatörü: 0.025 g Eriochrome Black T’yi 0.25 ml amonyaklı tampon içinde çözünüz, 25 ml’ye bidistile veya Milli-Q su ile hacim tamamlayınız. Damlalıklı küçük bir sisede saklayınız.
Deney,İ Yapılısı:
- Bir adet erlen ve uyan tıpasını hazırlayınız.
- 50 ml su numunesini mezür ile ölçerek 250 ml’lik erlene koyunuz.
- Toplam sertlik (Ca + Mg titrasyonu) tayini için herhangi bir kaynaktan; çesme suyu, havuz suyu, akü veya ütü suyu, akvaryum suyu vb. numune alınız.
- 2 ml amonyaklı tampon ekleyiniz.
- Çözelti açık pembe olana kadar Eriochrome Black T indikatörü ekleyiniz (genellikle 5-6 damla).
- Çözelti pembe renkten açık gri-mavi renge dönene kadar EDTA ile titre ediniz (bu dönme noktasını tecrübe ile görebilirsiniz, biraz alıştırma yapmak gerekebilir).
- Kullanılan EDTA hacmini kaydediniz.
- Deneyi iki-üç defa tekrar ederek en azından iki istikrarlı okuma elde ediniz.
Hesaplama:
“Toplam sertliği” = kullanılan EDTA hacmi x 400.8 μg Ca/ml EDTA hesabından bulunuz. Numunenizin hacmine bölerek su numunenizin “Ca cinsinden toplam sertligini” ppm olarak hesaplayınız.
7. Amonyak-Nitrit
7.1. Akvatik (Sucul, Akuatik) Sistemlerde Azot ve Azotlu Bilesiklerin Önemi
Azot canlı yapısının temel elementlerinden birisidir ve canlı materyallerin kuru agırlıklarının %5’ini olusturmaktadır. Azotun çogunlugu proteinlerde amino asitler olarak bulunur ve canlıların besininin vazgeçilmez bir bilesenini olusturur. Azotlu ürünler farklı hayvan gruplarında bosaltım, asit-baz dengesi, osmoregülasyon ve yüzme yetenegi gibi degisik fizyolojik fonksiyonlarda son ürün olarak görülmektedir. Buna ek olarak ortalama %25 civarında azotlu ürün yemlerle (%11-36) ya da diger besleyicilerle (organik ve inorganik gübreler) de ortama katılabilmektedir.
Bu sekillerde ortama katılabilen azot atıkları birikerek havuzların asimilasyon kapasitesinin üstüne çıkar. Su kalitesinin bozulmasına neden olan bu olay aynı zamanda sucul organizmalar için toksik etki yapmaktadır. Canlı bünyesinin yanı sıra besin maddelerinde ve ölü organizmalarda bulunan azot, dogada, atmosfer-su sisteminde azot siklusu (çevrimi, döngüsü) dedigimiz bir döngü içinde sürekli bir dolanım halindedir. Bu nedenle azot bilesiklerinin su kirliligi açısından önemli bir kilit rolü vardır. Bunların basında ötrofikasyon, O2 bilançosunun etkilenmesi ve içme sularındaki toksikolojik sorunlar gelir. Su ortamında bulunan azot bilesiklerini azot, organik azot, iyonize olmamıs amonyak, amonyum, toplam amonyak, nitrit ve nitrat olusmaktadır (Tablo 3).
Tablo 3. Su Ürünleri Yetistiricilik Sistemlerinde Baslıca Azot Formları (Lawson, 1995’ten degistirilerek)
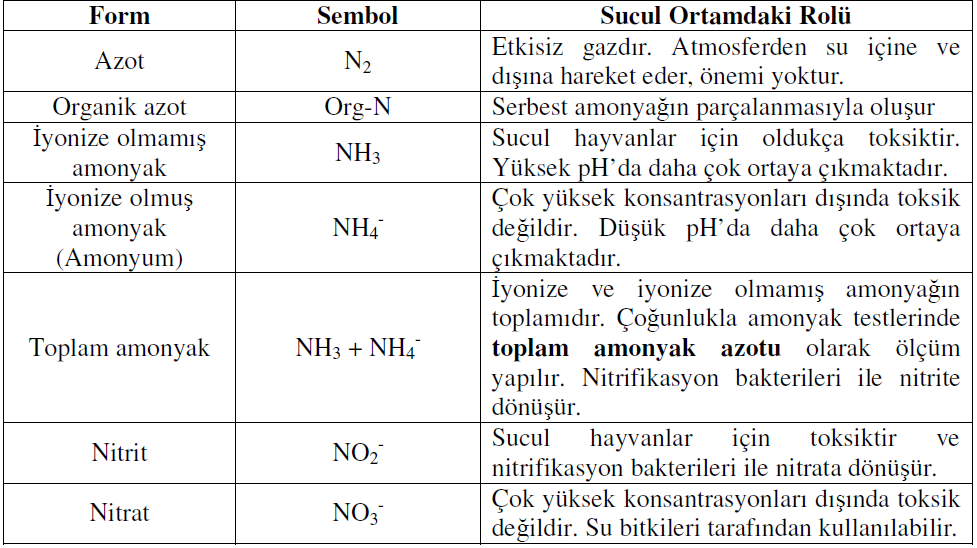
Akvatik ortamda amonyak ve nitrit en toksik azotlu bilesiklerdir. Nitritten farklı primer olarak balık tarafından üretilmesi dolayısıyla, amonyagın ve olusturdugu toksisitenin bilinmesi çok önemlidir.
7.2. Tatlısu Sistemlerinde Amonyak Kirliligi
7.2.1. Organik Orijinli Kirlilik
a) Akvatik organizmalrın ekstraksiyonu (özellikle intensif balık ve midye yetistiriciliginde)
b) Organik maddenin parçalanması- Bilhassa organik gübre ya da amonyak bazlı inorganik gübrelerle (amonyum sülfatlı gibi) havuzların gübrelenmesi ya da yem artıklarının toplanmaması sonrasında ortaya çıkar.
c) Denitrifikasyon– Azotlu bilesikler oksijeni bol sularda (oksijenle karısmıs sularda) nitrite ve zararsız olan nitrata dönüsür (Nitrifikasyon olayı). Oksijensiz sularda ise nitrat nitrite, oradan da amonyaga dönüsür (Denitrifikasyon). Bu nedenle, oksijen azlıgı havuz sistemlerinde amonyagın olusumuna neden olabilmektedir.
d) Evsel ve endüstriyel atıklar.
e) Plankton patlamaları sonucunda görülen ölüm-Havuz sistemlerinde yüksek düzeydeki amonyak, planktonların ölümü ile genel olarak iliskilidir. Amonyak toksisitesi salinitenin arttırılması ile ayrıca yüksek çözünmüs O2 ve CO2 konsantrasyonlarında düser.
7.2.2. İnorganik Orijinli Kirlilik
a) Endüstriel Atıklar
b) Bitki kökenli olarak bulunabilmektedir. Suda amonyak, pH ve sıcaklık arasındaki dengeye baglı olarak iki formda bulunur. Bu formlar iyonize olmamıs (NH3) ve iyonize olmus (NH4 –amonyum) amonyak formlarıdır. Bu iki formun toplamı ise toplam amonyak olarak adlandırılmaktadır ve sudaki formülü;
NH3 + nH2O __ NH4 + + OH- + (n-1) H2O seklinde gösterilebilir.
Organizmaların hücre duvarları amonyum iyonuna karsı geçirgen olmamasına karsın, iyonize olmamıs amonyak solungaç membranından kolayca geçebilmesi dolayısıyla daha toksiktir. Ayrıca normalkosullar altında su-doku ara yüzeyi arasında asit-baz dengesi vardır. Eger bu denge degisirse, iyonize olmamıs amonyak eklenerek pH bu bölgede düser. Bu iyonize olmamıs amonyagın sudan solungaç epiteline ve kana; kandan da dokulara nasıl geçtigini açıklamaktadır.
Amonyagın meydana getirdigi ölüme kadar varan olumsuz etkilerden korunmak için, gerek dogal sularda gerekse kültür kosullarında, suiçerisideki toplam amonyagın iyonize olmamıs formunun (NH3) miktarını bilmek önemlidir. Ayrıca solunum ile birlikte solungaçlardaki pH’n degeri ve böylece amonyagın oransal konsantrasyonu degisebilir. Amonyagın amonyum iyonuna oranı pH’da her birim artısla 10 kat, 0-300C artısla her 10 100C’de yaklasık 2 kat artar. Degisik pH ve sıcaklık degerlerinde sudaki amonyak formu çizelgelerden yararlanılarak tahmin edebilecegi gibi, ayrıca formüllerle de saptanabilir.
Sudaki iyonize amonyagın formülle hesaplanması;
K= [NH3] [H+] / [NH4 +]
K= Sıcaklıga baglı denge katsayısı
pK= -log10 K
T= Su sıcaklıgı (0C)
pK= 0.09018 + 2729.92 / 273.2 + T
İyonize olmamıs amonyak (NH3) = Total amonyak esitliginden yararlanılabilir.
1 + 10 pK-pH
Su ürünleri yetistiriciligi sistemlerinde açıklanamayan ölümlerin büyük bir kısmı iyonize olmamıs amonyak düzeyinin yükselmesine baglanmaktadır. Amonyak toksisitesi aynı zamanda sudaki çözünmüs O2 miktarının yanı sıra pH’nın etkisiyle serbest CO2 miktarına veya bikarbonat alkalinitesine de baglı olabilir. Solungaç yüzeyindeki CO2’in difüzyonu sudaki pH’ı düsürür, böylece iyonize olmamıs amonyak miktarının oranı düser. pH’nın sudaki düsüs miktarı su içindeki CO2 miktarına baglıdır. Tuzlu sularda toplam amonyagın % dengesi saliniteden de etkilenmektedir. Nitritin sekonder ve tersiyer aminlerle reaksiyona girerek nitrozaminleri verdigi bilinmektedir. İnsan midesinin pH’ı bu reaksiyon için uygundur. Nitrozaminlerin kanserojen maddeler oldukları bilinmektedir.
2NO2 + H2O _ NO2 – + NO3 – + 2H+
Nitritin oksidasyonu ile kandaki hemoglobin methemoglobin formuna dönüsür. Bu sekilde oksijen taşınması engellenmiş olunur. Bu durumlarda solunum güçlükleri ve boğulmalar gözlenir. Kan rengi ve solungaçlar koyu çikolata renge döner. Bu hastalığa “methemoglobinemia” adı verilir.
7.3. Deneyin Adı: Suda Amonyak Tayini
MATERYAL: Degisik kaynaklardan su örnekleri (çesme suyu örnegi bir gece önce alınmalı kloru uçurulmalıdır)
- Beher, 50 ml, 5 adet
- Cam pipet, 2 ml ve 5 ml
- Standard çözeltilerin hazırlanması için balon jojeler
- Nessler reaktifi
- Spektrofotometre
Nessler Reaktifi:
a) 100 g civa iyodür (HgI2) ve 70 g potasyum iyodür (Kl) az miktarda amonyaksız saf suda çözülür.
b) 100 g sodyum hidroksit (NaOH) 500 ml amonyaksız saf suda çözülür. a ve b çözeltileri karıstırılıp 1000 ml’ye seyreltilir. Filtre edilir. Koyu sisede saklanır.
Stok I Amonyak Çözeltisi: 3.819 g amonyum klorür, NH4Cl (susuz) saf su ile 1000 ml’ye seyreltilir. Bu çözeltinin 1 ml’si 1.22 mg NH3 içerir ya da 1 ml’si 1.0 mg NH3-N içerir.
Stok II Standard Amonyak Çözeltisi: 10 ml stok I alınır; 1000 ml’ye seyreltilir. Bu çözetinin 1 ml’si 0.01 mg NH3-N = 0.0122 mg NH3 1 L’si 10 mg NH3-N = 12.2 mg NH3 içerir.
Kalibrasyon Standartları: Standart amonyak çözeltisi (Stok II)’inden sırayla 1, 2, 4 ve 6 ml alınarak her biri distile su ile 50 ml’ye tamamlanır.
Standard Egri için Çözeltilerin Hazırlanması:
| Stok II’den alınan miktar / 50 ml distile su | İhtiva ettigi NH3-N(mg/ml) |
| 1 | 0.2 |
| 2 | 0.4 |
| 4 | 0.8 |
| 6 | 1.2 |
DENEY_N YAPILISI:
- 50 ml örnek ve standard çözeltilerin her birinin üzerine 2 ml Nessler reaktifi ilave edilerek karıstırılır. 15 dakika renk gelisimi için beklenir. Sarıdan kahverengine degisen bir renk olmalıdır.
- Olusan absorbans spektrofotometrede 410 dalgaboyunda ölçülür.
- Hazırlanan kalibrasyon egrisinden denklem yardımıyla bilinmeyen numunenin absorbansı okunarak, konsantrasyonu mg/ml cinsinden hesaplanır.
- Eger tortu olusursa örnek seyreltilerek tekrar isleme alınır.
Deneyin Adı: Su Numunelerinde Sıcaklık, Kondüktivite (İletkenlik), Ph, Çözünmüs Oksijen (Do) Tayini-Su Kalitesi
GENEL BİLGİ: Su kalitesine karar vermenin bir yolu, suda çözünmüs oksijen gazı ve karbon dioksit gazı miktarını tayin etmektir. Kirli suyun oksijen muhtevası düsüktür. Aynı zamanda karbon dioksit muhtevası da yüksektir. Temiz suyun oksijen muhtevası yüksektir. Sudaki oksijen ve karbon dioksitin kaynagı havadır. Canlıların fotosentezi ve solunumu da oksijen ve karbon dioksit miktarına katkıda bulunur. Dünya atmosferinde ilk oksijen Cyanobacteria’nın fotosentez yapmasıyla saglandı. Bu deneyde elde edilen verilerden çözünmüş oksijen (DO) ve karbon dioksit miktarı ppm (milyonda kısım) olarak tayin edilmektedir. Sonucuna göre su kalitesi belirlenmektedir.
Test edilen suyun DO muhtevası derinlik, bulanıklık, türbülans, sıcaklık, çamur birikintileri, ısık, mikropların faaliyeti, karışma, hareket süresi ve diger faktörlere baglıdır. Deney çözünmüs oksijen tayinini (DO) Winkler metoduna göre yapmaktadır. DO analizi iki metodla yapılmaktadır: (i) Winkler veya iyodometrik metod Winkler metodu titritmetrik, yas kimyasal bir metottur. Yavas ancak güvenilirligi ve hassasiyeti yüksek referans metod olarak tercih edilir.
Çözünmüs oksijenin okside edici özelligine dayanır. Belirli oksidan maddeler iyodürlerden iyot açıga çıkarır. Organik maddenin çogu, oksitlenmis mangan asidifiye edildiginde çökeldiginden, kısmen oksitlenir. Genel prensip numunede bulunan çözünmüş oksijen miktarıyla orantılı olarak iyotun açıga çıkacagına dayanır. Nisastayı indikatör olarak sodyum tiyosülfatla reaksiyona sokunca numune titrasyona tabi tutulur ve çözünmüs oksijen miktarı tayin edilebilir.
(ii) Elektrometrik metot. Elektrometrik metod ise moleküler oksijenin bir membrandan difüzyon hızına dayanır. Bu metottakullanılan membran elektrodlar (DO elektrodu) numunenin sıcaklıgına ve atmosferik basıncına hassastır. Hızlı sonuç alınması gerektiginde ve kullanım kolaylıgı bakımından tercih edilir.
MATERYAL: Degisik kaynaklardan su numuneleri, alınma tarihi ve yeri etiketinde belirtilmis (her grup için)
- Lam ve lamel
- Metilen mavisi
- YSI marka oksijenmetre, probları ile birlikte
- Isık mikroskobu
DENEYİN YAPILISI:
Su numuneleri renk, koku, berraklık (turbidite), partiküller ve askıda madde varlıgı yönünden makroskopik olarak incelenir. Su numuneleri ısık mikroskobunda lam lamel arasına bir damla numune alınarak incelenir, gözlemler kaydedilir. Ayrı bir lam’daki su numunesine bir damla metilen mavisi damlatılarak tekrar incelenir. Oksijenmetrenin elektrodu ile sıcaklık, konduktivite, pH ve çözünmüs oksijen ölçülerek kaydedilir. Sınıf bütün grupların sonuçlarını paylasarak defterlere ortak verilerin raporu yazılır, kendi grubunun degerlerini belirtir.




Yorum yap